열역학의 법칙 - 개념과 특징
열역학 법칙이 무엇인지, 이러한 원리의 유래는 무엇인지, 각 법칙의 주요 특징을 설명합니다.

열역학 법칙은 우주의 물리적 법칙을 이해하는 데 사용됩니다.
열역학 법칙은 무엇입니까?
열역학 법칙(또는 열역학 원리)은 열역학 시스템을 특징짓는 세 가지 기본 물리량인 온도 , 에너지 , 엔트로피 의 동작 을 설명합니다. "열역학"이라는 용어는 " 열 "을 의미하는 그리스 보온병(thermos ) 과 " 힘 "을 의미하는 다이나모스(dynamos )에서 유래되었습니다 .
수학적으로 이러한 원리는 연구 대상( 분자 또는 인간 부터 대기 또는 냄비의 끓는 물 까지 )으로 정의되는 열역학 시스템의 동작을 설명하는 일련 의 방정식 으로 설명됩니다 .
열역학에는 네 가지 법칙이 있으며 이는 우주 의 물리적 법칙 과 영구 운동 과 같은 특정 현상의 불가능성을 이해하는 데 중요합니다 .
참조: 에너지 보존 원리
열역학 법칙의 유래
열역학 의 네 가지 원리는 기원이 다르며 일부는 이전 원리에서 공식화되었습니다 . 실제로 처음으로 확립된 것은 1824년 프랑스의 물리학자이자 엔지니어인 니콜라스 레오나르 사디 카르노(Nicolás Léonard Sadi Carnot)의 작품인 두 번째였습니다.
그러나 1860년에 이 원리는 루돌프 클라우지우스(Rudolf Clausius)와 윌리엄 톰슨(William Thompson)에 의해 다시 공식화되었으며, 이어서 오늘날 우리가 열역학 제1법칙이라고 부르는 것을 추가했습니다. 세 번째는 나중에 나타났는데, 이는 1906년에서 1912년 사이에 발터 네른스트(Walther Nernst)의 연구 덕분에 생겨났기 때문에 "네르스트(Nerst)의 가설"이라고도 알려져 있습니다.
마침내 1930년 구겐하임과 파울러가 제안한 이른바 '제로의 법칙'이 등장했다 . 모든 분야에서 진정한 법으로 인정되는 것은 아니라고 해야 할 것이다.
열역학 제1법칙

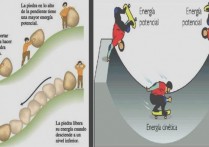
에너지는 생성되거나 파괴될 수 없으며 단지 변형될 뿐입니다.
첫 번째 법칙은 환경으로부터 분리된 모든 물리적 시스템 에서 에너지가 한 형태에서 다른 형태로 변환될 수 있더라도 에너지의 총량은 항상 동일하다는 것을 규정하기 때문에 "에너지 보존의 법칙"이라고 불립니다. . 즉, 에너지는 생성되거나 파괴될 수 없으며 단지 변형될 뿐입니다.
이러한 방식으로 물리적 시스템에 일정량의 열(Q)을 공급함으로써 시스템의 총 에너지량은 공급된 열에서 시스템이 주변에 행한 일 (W)을 뺀 값으로 계산할 수 있습니다. 공식으로 표현: ΔU = Q – W.
이 법칙의 예로 비행기 엔진을 상상해 봅시다 . 연소 과정에서 화학적으로 반응하여 열을 방출하고 일(비행기를 움직이게 하는) 작업을 수행하는 연료로 구성된 열역학적 시스템입니다 . 따라서 수행된 일의 양과 방출된 열의 양을 측정할 수 있다면 시스템의 총 에너지를 계산할 수 있으며 비행 중에 엔진의 에너지가 일정하게 유지된다는 결론을 내릴 수 있습니다. 열 에너지 와 운동 에너지 (운동, 즉 일) 에 대한 화학 에너지 .
열역학 제2법칙

충분한 시간이 주어지면 모든 시스템은 결국 불균형을 향해 나아가는 경향이 있습니다.
'엔트로피의 법칙'이라고도 불리는 두 번째 법칙은 우주의 엔트로피 양은 시간이 지남에 따라 증가하는 경향이 있다는 것으로 요약할 수 있습니다 . 이는 시스템이 가장 무질서한 상태인 평형점에 도달할 때까지 시스템의 무질서 정도가 증가한다는 것을 의미합니다.
이 법칙은 물리학의 기본 개념, 즉 엔트로피 개념(문자 S로 표시)을 도입하며, 이는 물리적 시스템의 경우 무질서의 정도를 나타냅니다. 에너지 변환이 일어나는 모든 물리적 과정에서 일정량의 에너지는 사용할 수 없습니다. 즉, 일을 할 수 없다는 것이 밝혀졌습니다. 일을 할 수 없다면 대부분의 경우 그 에너지는 열입니다. 시스템이 방출하는 열, 시스템이 하는 일은 시스템의 무질서, 즉 엔트로피를 증가시키는 것입니다. 엔트로피는 시스템의 무질서를 측정하는 것입니다.
이 법칙의 공식화에 따르면 엔트로피 변화(dS)는 항상 열 전달 (dQ)을 시스템의 온도(T)로 나눈 값보다 크거나 같습니다. 즉, dS ≥ dQ / T입니다.
예를 들어 이를 이해하려면 일정량의 물질을 태운 다음 생성된 재를 모으는 것으로 충분합니다. 무게를 달아 보면 그것이 초기 상태보다 물질이 적다는 것을 확인할 수 있습니다. 물질의 일부는 시스템에 작용할 수 없고 시스템의 무질서에 기여하는 가스 형태의 열로 변환되었습니다.
열역학 제3법칙

절대 영도에 도달하면 물리적 시스템의 프로세스가 중지됩니다.
세 번째 법칙은 절대 영도에 도달한 계의 엔트로피는 일정한 상수가 될 것이라고 말합니다 . 다시 말해서:
-
절대 영도(켈빈 단위의 영점)에 도달하면 물리적 시스템의 프로세스가 중지됩니다.
-
절대 영도(켈빈 단위의 영)에 도달하면 엔트로피는 일정한 최소값을 갖습니다.
매일 소위 절대 영도(-273.15°C)에 도달하기는 어렵지만 , 냉동실 에서 일어나는 일을 분석하면 이 법칙에 대해 생각할 수 있습니다. 내부의 생화학적 과정을 늦추거나 멈추게 합니다. 그렇기 때문에 분해가 지연되어 훨씬 오랫동안 섭취하기 에 적합합니다 .
열역학의 "제로" 법칙

"영의 법칙"은 논리적으로 다음과 같이 표현됩니다. A = C이고 B = C이면 A = B입니다.
"제로 법칙"은 마지막으로 제안되었지만 그 이름으로 알려져 있습니다. 열평형의 법칙 으로도 알려진 이 원리는 다음과 같이 규정합니다. "두 시스템이 세 번째 시스템과 독립적으로 열평형 상태 에 있다면 , 두 시스템도 서로 열평형 상태에 있어야 합니다." 이는 논리적으로 다음과 같이 표현될 수 있습니다. A = C이고 B = C이면 A = B입니다.
이 법칙을 통해 세 가지 서로 다른 물체 A, B, C의 열에너지를 비교할 수 있습니다. 물체 A가 물체 C와 열 평형 상태에 있고(온도가 동일함) B도 C와 온도가 같다면 A와 C는 같습니다. B의 온도는 같습니다.
이 원리를 설명하는 또 다른 방법은 온도가 다른 두 물체가 접촉할 때 온도가 같아질 때까지 열을 교환한다고 주장하는 것입니다.
이 법칙의 일상적인 예는 쉽게 찾을 수 있습니다. 우리가 차가운 물이나 뜨거운 물에 들어가면 우리 몸은 물 과 열 평형 상태에 들어가 더 이상 그 차이를 느끼지 못하기 때문에 처음 몇 분 동안만 온도의 차이를 느낄 것입니다. 우리가 뜨겁거나 차가운 방에 들어갈 때도 똑같은 일이 일어납니다. 처음에는 온도를 알아차리지만 그 다음에는 온도와 열평형에 들어가게 되므로 차이를 알아차리지 못하게 됩니다.