엔트로피 - 개념, 예제 및 마이너스 엔트로피
엔트로피가 무엇인지, 음의 엔트로피는 무엇으로 구성되어 있는지, 그리고 시스템의 균형 정도에 대한 몇 가지 예를 설명합니다.

엔트로피는 충분한 시간이 주어지면 시스템이 무질서해지는 경향이 있다고 말합니다.
엔트로피란 무엇인가?
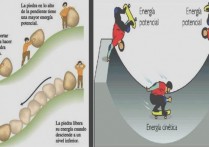
물리학 에서 우리는 열역학 시스템의 평형 정도를 나타내 거나 오히려 무질서해지는 경향(엔트로피의 변화) 수준을 나타내기 위해 엔트로피(보통 문자 S로 기호화됨)를 말합니다 . 양의 엔트로피 변화가 발생하면 시스템의 구성 요소는 음의 엔트로피가 발생할 때보다 더 큰 무질서 상태가 됩니다.
엔트로피는 “ 우주 의 엔트로피 양은 시간이 지남에 따라 증가하는 경향이 있다 ” 는 열역학 제2법칙의 핵심 개념입니다. 또는 동일한 것입니다. 충분한 시간이 주어지면 시스템은 무질서해지는 경향이 있습니다 . 이러한 무질서 가능성은 시스템이 평형에 가까워질수록 더욱 커집니다. 균형이 클수록 엔트로피도 커집니다.
엔트로피는 작업을 수행하는 데 유용하지 않지만 주어진 시스템에 존재하고 축적되는 시스템의 내부 에너지를 계산한 것이라고 할 수도 있습니다 . 즉, 잉여, 일회용 에너지 입니다.
시스템이 초기 상태에서 2차 상태로 바뀔 때, 등온 과정(동일한 온도 )에서 엔트로피 변화(S 2 – S 1 ) 는 시스템이 환경 과 교환하는 열의 양과 같습니다 . Q 1 → Q 2 )를 온도로 나눈 값입니다. 이는 다음 방정식으로 표현됩니다.
S 2 – S 1 = (Q 1 → Q 2 )/ T
이는 시스템 의 엔트로피 변화만 계산할 수 있으며 절대값은 계산할 수 없음을 보여줍니다. 엔트로피가 0인 유일한 지점은 절대 영도(0K 또는 -273.16°C)입니다.
도움이 될 수 있습니다: 엔탈피
음의 엔트로피
음의 엔트로피, 신트로피 또는 네겐트로피는 시스템 이 엔트로피 수준을 낮게 유지하기 위해 내보내거나 방출하는 엔트로피입니다 .
이 개념은 1943년 물리학자 에르빈 슈뢰딩거(Erwin Schrödinger)에 의해 개발되었으며 이후 다양한 학자들에 의해 채택되었습니다.
엔트로피의 예

물리학은 엔트로피가 최대치에 도달하면 우주의 종말을 경고합니다.
엔트로피의 일상적인 예는 다음과 같습니다.
접시가 깨지는 것. 판을 높은 엔트로피 잠재력을 지닌 질서 있고 균형 잡힌 시스템으로 이해한다면 판의 조각화는 반대 방향으로 자발적으로 발생하지 않는 자연스럽고 일시적인 사건임을 알 수 있습니다.
방사성 붕괴. 역시 비가역적인 이 과정은 높은 엔트로피 전하를 지닌 불안정한 원자를 더욱 안정적인 원자로 만듭니다(원소 변화). 이를 위해 그들은 우리가 방사선이라고 부르는 많은 양의 에너지를 방출합니다.
우주 의 종말 . 현대 물리학은 "열사"라고 불리는 우주 종말 이론에 대해 경고했습니다. 이 이론은 우주의 엔트로피가 어느 시점에서 운동 과 열 전달이 멈출 때 최대 엔트로피 지점인 평형에 도달할 것이라고 주장합니다. 더 이상 어떤 종류의 진화나 변화도 없을 것입니다.