엔탈피 - 개념, 유형 및 엔트로피 차
엔탈피가 무엇인지, 화학적, 물리적 현상에 따라 존재하는 종류, 엔트로피와의 차이점에 대해 설명합니다.

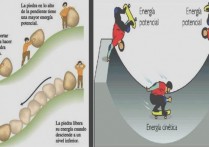
엔탈피는 일정한 압력에서 공정에 투입되는 에너지의 양입니다.
엔탈피란 무엇입니까?
엔탈피는 열역학 시스템이 일정한 압력 조건에서 환경과 교환하는 에너지 의 양입니다 . 즉, 압력이 변하지 않는 과정에서 시스템이 환경으로 흡수하거나 방출하는 에너지의 양입니다. 물리학 및 화학 에서 이 크기는 일반적으로 문자 H로 표시되며 줄 (J) 단위로 측정됩니다.
모든 물체가 열역학 시스템으로 이해될 수 있다는 점을 고려하면, 엔탈피는 시스템이 에너지를 받거나 제공하는지 여부에 따라 일정한 압력 조건에서 작용하는 열의 양을 나타냅니다.
이에 따르면 모든 프로세스나 변환은 두 가지 유형으로 분류될 수 있습니다.
-
흡열성. 환경 으로부터 열이나 에너지를 소비하는 것 .
-
발열. 열이나 에너지를 환경으로 방출하는 것.
시스템에 포함된 물질의 유형(예: 반응 의 화학물질 )에 따라 엔탈피 정도가 달라집니다.
초전도성을 발견하고 1913년 노벨 물리학상을 수상한 네덜란드 물리학자 하이케 카메를링 온네스(Heike Kamerlingh Onnes)가 이 용어를 처음으로 사용했습니다.
참조: 흡열 반응
엔탈피의 종류

연소엔탈피는 물질 1몰이 연소할 때 방출되거나 흡수되는 에너지입니다.
다양한 유형의 엔탈피는 다음과 같이 분류될 수 있습니다.
-
화학 현상의 엔탈피 :
-
형성 엔탈피. 표준 압력 및 온도 조건 , 즉 1기압, 25°C 에서 구성 원소로부터 화합물 1 몰을 형성 하는 데 필요한 에너지의 양입니다.
-
분해 엔탈피. 반대로 복잡한 물질이 단순한 물질로 변할 때 흡수되거나 방출되는 에너지의 양입니다.
-
연소 엔탈피. 항상 기체 산소가 있는 상태에서 물질 1몰이 연소될 때 방출되거나 흡수되는 에너지입니다 .
-
중화 엔탈피. 이는 산성 용액과 염기성 용액이 혼합될 때마다, 즉 염기와 산이 서로 중화될 때 방출되거나 흡수되는 에너지를 포함합니다 .
-
물리적 현상의 엔탈피 :
설명된 모든 프로세스는 일정한 압력을 받고 있다는 점에 유의해야 합니다.
엔탈피와 엔트로피
엔탈피와 엔트로피(계의 무질서 정도 또는 경향)의 개념은 평형 상태에 있는 모든 계가 최대 엔트로피 지점에 있다는 열역학 제2원리와 관련이 있습니다 .
이 원리는 시스템과의 에너지 교환이 풍부하거나 특정 한계를 초과하는 한 평형을 이룰 수 없다는 최소 엔탈피의 원리로 해석됩니다. 평형은 가능한 가장 낮은 교환 상태, 즉 기록 가능한 가장 낮은 엔탈피 상태여야 합니다.
이는 엔트로피와 엔탈피가 반비례한다는 것을 의미합니다 . 즉, 엔트로피의 최대점에서 엔탈피는 최소가 되고 그 반대의 경우도 마찬가지입니다.
더 보기: 엔트로피